肥胖患者通常会观察到骨骼肌的新陈代谢和耐力下降,但其潜在机制尚不清楚。由香港大学(港大)理学院生物科学学院助理教授陈志斌博士领导的研究小组发现了一种新机制来解释肥胖如何危害骨骼肌的功能,并提供一个潜在的治疗疾病。研究结果最近发表在Autophagy杂志上。
肥胖是一种代谢紊乱,在现代社会中越来越普遍。自1970年代以来,全球肥胖人数增加了两倍,2016年达到6.5亿(约占全球总人口的13%)。众所周知,肥胖会导致多个人体器官的不良后果,并导致许多慢性疾病,例如糖尿病、高血压、脂肪肝和动脉粥样硬化。在骨骼肌脂肪代谢肌肉的肥胖患者比健康人,其中科学家认为是功能异常线粒体的结果(单元格的强国,其将营养物质转化为生物能源)的慢。然而,肥胖如何损害线粒体的活动是一个长期悬而未决的问题。
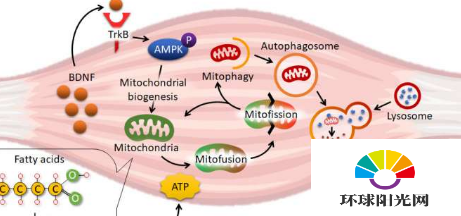
为了研究肥胖对骨骼肌的功能影响,陈博士的团队通过去除骨骼肌中专门的脑源性神经营养因子(BDNF)基因,开发了一种特殊的肥胖小鼠模型。BDNF最初被确定为维持神经元存活和活动的重要生长因子。最近的研究提出BDNF也是一种肌肉分泌蛋白(即myokine),但其生理意义尚不清楚。
陈博士的团队首次发现,肥胖会降低小鼠骨骼肌中BDNF的含量。他们还观察到,肌肉中没有BDNF的小鼠,称为“MBKO”(肌肉特异性BDNF敲除),当给动物喂食高脂肪饮食时,体重增加更多,胰岛素抵抗更严重。此外,研究小组发现MBKO小鼠的能量消耗低于对照组。
研究小组通过多项生化、组织学、代谢组学和分子分析,进一步证明MBKO小鼠肌肉中的线粒体无法再循环,导致组织中受损线粒体的积累。因此,MBKO小鼠肌肉中的脂质代谢减慢,导致更多的脂质积累干扰胰岛素敏感性。
“显然,肌肉来源的BDNF是一种通过增加能量消耗和维持胰岛素敏感性来控制体重的蛋白质,”陈博士说。
“长期以来,BDNF一直被认为是一种大脑定位肽,它在外周组织中的重要性被低估了。我们的研究为该领域提供了新的见解,希望我们可以使用我们的MBKO小鼠来解锁这种肌因子的更多功能,”博士说。陈进一步补充道。
除了动物研究外,陈博士的团队还利用培养的细胞模型来确定缺乏BDNF的肌肉细胞中线粒体更新缺陷的分子机制。他们发现,肌肉分泌的BDNF使用AMPK激活的蛋白激酶(细胞中众所周知的能量传感器)来触发Parkin/PINK1通路以诱导线粒体自噬(一种高度调节的机制,可回收细胞中的材料以应对各种挑战)在骨骼肌中。
为了将这些发现扩展到治疗应用,研究小组进一步测试了恢复肌肉中的BDNF信号是否可以挽救肥胖引起的线粒体损伤。他们用目前用于阿尔茨海默病临床试验的7,8-二羟基黄酮(一种天然生物可利用的BDNF模拟物(存在于南美洲的植物物种Godmaniaaesculifolia的叶子中)来喂养肥胖小鼠,并发现肥胖——诱导的线粒体功能障碍得到缓解。
连同先前的研究结果,即7,8-DHF是减轻肥胖小鼠体重和改善胰岛素敏感性的有效药物(ChemBiol201522:355-369;Metabolism201887:113-122),陈博士的工作提供对肥胖有害性质的新解释,并表明BDNF信号增强剂(如7,8-DHF)是治疗人类肥胖症的潜在药物。