构成人体的数万亿个细胞中的每一个每天都会遭受超过10,000个DNA损伤。如果细胞无法修复它们,这些损伤将是灾难性的,但是检测和修复遗传损伤的非常精密的机器正在发挥作用,以防止DNA突变和癌症等疾病。在机器学习应用于高通量显微镜等技术的帮助下,研究员BárbaraMartínez是由国家癌症研究中心(CNIO)的AlejoEfeyan领导的代谢和细胞信号传导小组的成员,以及RaulMostoslavsky和他的来自马萨诸塞州总医院(波士顿)的团队成功地详细可视化了这种DNA修复机制,并确定了新的修复蛋白。这些结果是在波士顿设计的,在波士顿和马德里之间开发,并于本周发表在CellReports可以帮助开发新的癌症疗法。
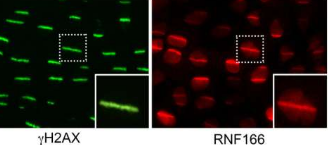
马丁内斯解释说,一旦出现DNA损伤,例如DNA双链断裂,细胞就会激活一种名为DNA损伤反应的机制,就像“呼叫紧急服务”一样。蛋白质会迅速结合受损的DNA发出警报信号,这些信号会被其他专门修复损伤的蛋白质识别。
化疗的目标是通过诱导DNA损伤来杀死肿瘤细胞,从而导致癌细胞崩溃和死亡。“通过了解DNA损伤如何发生以及它们如何修复,我们将更多地了解癌症如何发展以及我们如何对抗它。DNA修复方面的任何新发现都将有助于开发更好的癌症疗法,同时保护我们的健康细胞,”马丁内斯说.
研究人员开发了一种新方法,在CNIO共聚焦单元设计的机器学习分析方法的帮助下,能够以前所未有的详细程度和精确度对这一过程进行分析。“到目前为止,跟踪DNA修复动力学的一个限制因素是无法处理和分析显微镜拍摄的图像产生的数据量。”
研究人员使用了高通量显微镜,可以在诱导遗传损伤后获取数千张细胞图片。在第一阶段,他们将300多种不同的蛋白质引入细胞,并在一次实验中评估它们是否会随着时间的推移干扰DNA修复。这项技术导致发现了九种参与DNA修复的新蛋白质。
但作者决定更进一步,在产生遗传损伤后对300种蛋白质进行目视监测。为此,他们采用了一种经典的DNA微辐照技术——用紫外线激光损伤DNA——首次大规模使用,并分析了所研究的300种蛋白质的行为。
“我们看到许多蛋白质粘附在受损的DNA上,而其他蛋白质则恰恰相反:它们远离了DNA病变。事实上,它们要么结合受损DNA,要么从受损DNA中移除,从而使修复蛋白募集到病变部位,是DNA修复蛋白的一个共同特征。这两种现象都是相关的”。
发现的蛋白质之一是PHF20。作者表明,这种蛋白质在损伤后几秒钟内就会远离病变,以促进53BP1的募集,53BP1是一种对DNA修复至关重要的蛋白质。没有PHF20的细胞无法正确修复其DNA,并且比正常细胞对辐射更敏感,表明PHF20对DNA修复很重要。
这些技术为研究DNA修复和操纵它提供了新的机会。“一个优势是这两个平台都非常通用,可用于发现影响DNA修复的新基因或化合物。我们通过使用允许DNA修复直接可视化的技术,在最短的时间内评估了数百种蛋白质。”
这项工作得到了西班牙科学与创新部、卡洛斯三世卫生研究所、国立卫生研究院、玛丽居里COFUNDFP7、麻省总医院、欧洲研究委员会和自然科学与工程研究的资助加拿大理事会。